Es ist seit langem bekannt, dass alle Moleküle zwei gleiche und entgegengesetzte Ladungen besitzen, die durch einen bestimmten Abstand voneinander getrennt sind. Bei solchen polaren Molekülen fällt das Zentrum der negativen Ladung nicht mit dem Zentrum der positiven Ladung zusammen. Das Ausmaß der Polarität in solchen kovalenten Molekülen kann durch den Begriff Dipolmoment beschrieben werden, der im Wesentlichen das Maß für die Polarität in einer polaren kovalenten Bindung ist.
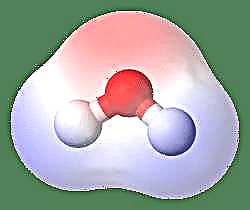
Das einfachste Beispiel für einen Dipol ist ein Wassermolekül. Ein Wassermolekül ist polar, weil sich seine Elektronen ungleichmäßig in einer „gebogenen“ Struktur teilen. Das Wassermolekül bildet einen Winkel mit Wasserstoffatomen an den Spitzen und Sauerstoff am Scheitelpunkt. Da Sauerstoff eine höhere Elektronegativität als Wasserstoff aufweist, ist die Seite des Moleküls mit dem Sauerstoffatom teilweise negativ geladen, während der Wasserstoff im Zentrum teilweise positiv geladen ist. Aus diesem Grund zeigt die Richtung des Dipolmoments zum Sauerstoff.
In der Sprache der Physik ist das elektrische Dipolmoment ein Maß für die Trennung von positiven und negativen elektrischen Ladungen in einem Ladungssystem, dh ein Maß für die Gesamtpolarität des Ladungssystems - dh die Trennung der elektrischen Ladung der Moleküle, die führt zu einem Dipol. Mathematisch und im einfachen Fall von zwei Punktladungen, eine mit Ladung + q und eine mit Ladung? Q, kann das elektrische Dipolmoment p ausgedrückt werden als: p = qd, wobei d der Verschiebungsvektor ist, der von der negativen Ladung nach zeigt die positive Ladung. Somit zeigt der elektrische Dipolmomentvektor p von der negativen Ladung zur positiven Ladung.
Eine andere Sichtweise besteht darin, das Dipolmoment durch den griechischen Buchstaben m, m = ed darzustellen, wobei e die elektrische Ladung und d der Abstand ist. Es wird in den Einheiten von Debye ausgedrückt und als D geschrieben (wobei 1 Debye = 1 x 10-18e.s.u cm). Ein Dipolmoment ist eine Vektorgröße und wird daher durch einen kleinen Pfeil mit einem Schwanz in der positiven Mitte und einem Kopf in Richtung einer negativen Mitte dargestellt. Im Fall eines Wassermoleküls beträgt das Dipolmoment 1,85 D, während ein Salzsäuremolekül 1,03 D beträgt und wie folgt dargestellt werden kann:
Wir haben viele Artikel über Dipolmomente für das Space Magazine geschrieben. Hier ist ein Artikel darüber, woraus Wasser besteht, und hier ist ein Artikel über Moleküle.
Wenn Sie weitere Informationen zum Dipolmoment wünschen, lesen Sie diese Artikel von Hyperphysics and Science Daily.
Wir haben auch eine ganze Episode von Astronomy Cast rund um Moleküle im Weltraum aufgenommen. Hören Sie hier, Episode 116: Moleküle im Weltraum.
Quellen:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule